O sistema muscular esquelético é constituído por unidades celulares, as fibras musculares estriadas esqueléticas, alongadas, dispostas paralelamente, com citoplasma e um ou vários núcleos em sua periferia, com um aspecto estriado característico ao microscópio, constituídas por 75% de água e 20% de proteína. A matriz extracelular é fundamental para o funcionamento normal do músculo, manutenção e cicatrização. Uma lâmina basal contém fibras colágenas, proteínas não colagenosas e proteoglicanos.
As fibras musculares crescem em comprimento e diâmetro desde o nascimento até a idade adulta e seu diâmetro aumenta em até cinco vezes. O comprimento da fibra muscular varia entre 5 mm a 50 cm e seu diâmetro entre 0,01 a 0,1 mm.
As lâminas basais juntamente com as fibras de colágeno formam o ENDOMÍSIO, uma delicada bainha de tecido conjuntivo que envolve cada fibra muscular. As fibras musculares ficam agrupadas em fascículos, que são envoltos por uma bainha de tecido conjuntivo, denominado PERIMÍSIO (reveste 10 a 300 fibras musculares). Perimísio e endomísio conferem ao músculo parte de sua capacidade de “alongamento” e retorno ao comprimento normal em repouso. O músculo como um todo compõe- se de vários fascículos envoltos pelo EPIMÍSIO, que reveste o músculo, confere sua forma final e se une à fáscia suprajacente ao músculo e à junção musculotendinosa. A rede intramuscular de tecidos conjuntivos se funde e torna-se contínua com o denso tecido conjuntivo dos tendões em cada extremidade de um músculo.
A fibra muscular contém de várias centenas a muitos milhares de miofibrilas, elementos proteicos contráteis, mergulhados na matriz sarcoplasmática. Os componentes subcelulares, como lipídeos, glicogênio, fosfocreatina, ATP, enzimas, ficam suspensos nesse fluido viscoso. Um grande número de mitocôndrias se localiza entre e paralelamente às miofibrilas, além de um amplo e difuso retículo endoplasmático, orientado longitudinalmente às miofibrilas.
A fibra muscular é formada de miofilamentos de 0,5 a 2 micra de diâmetro (1 micra = 1/1000 mm). O sarcômero constitui-se na menor unidade contrátil do músculo delimitado pelas linhas Z. A miofibrila estriada é composta de filamentos de proteína contráteis: actina (filamentos finos) e miosina (filamentos grossos). A miosina e a actina são dispostas no músculo seguindo padrões repetidos de bandas, onde cada unidade dessa banda é chamada de sarcômero. Durante a contração, os filamentos de actina são tracionados em direção aos filamentos de miosina deslizando- se entre si; o músculo diminui de tamanho e aumenta o seu diâmetro.
Na camada mais externa do sarcolema da fibra muscular estão presentes pequenas células mononucleadas indiferenciadas e inespecíficas, chamadas “células-satélites”, elementos fundamentais no processo de regeneração de fibras musculares lesadas.
A inervação muscular é 60% motora e 40% sensitiva. Existe cerca de 1/4 de bilhão de fibras musculares na corporação total da musculatura esquelética do homem, e cerca de 420.000 nervos motores, o que denota uma relação de ramificação de fibras nervosas. Fibras musculares inervadas pelo mesmo neurônio motor se contraem e se relaxam ao mesmo tempo. Cada fibra nervosa que penetra no músculo inerva muitas fibras musculares. O neurônio motor somado às fibras musculares por ele inervadas formam uma unidade motora.
O músculo estriado esquelético é responsável por contrações regulares, rápidas e poderosas e ação voluntária descontínua, o que o diferencia do dos músculo liso e cardíaco.
A função adequada da contração muscular depende da função normal e integridade de todas as unidades motoras em todos os seus componentes. Cada unidade motora conta, em média, com a inervação de 100 a 10.000 fibras musculares, dependendo do principal papel fisiológico da massa muscular. Além de determinar cada tipo de fibra muscular histoquímica, os estímulos da unidade motora participam através de fatores tróficos diretos e estímulos químicos da membrana pós-junção na placa motora.
Todas as fibras musculares inervadas por um determinado tipo de unidade motora são do mesmo tipo histoquímico e permanecem geralmente próximas um da outra, mas não agrupadas entre si, dando a aparência típica de “mosaico entre diferentes fibras histoquímicas. Dois tipos principais de fibras musculares foram delineados. As fibras de tipo 1 (ou contração lenta) são muito oxidativas e apresentam uma contração lenta, sendo recrutado durante atividades físicas de longa duração ou alta resistência, por sua maior resposta a exercícios de resistência e resistência à fadiga. O tipo 2A apresenta um padrão de contração rápida com atividades oxidativas e glicolíticas, sendo principalmente recrutado durante atividades de curta e alta intensidade e apresentando altos níveis de fosfatofrutoquinase e succinato desidrogenase. O tipo 2B apresenta uma maior capacidade de glicolítico e anaeróbico e, portanto, contrações mais fatigáveis durante as tarefas. Cada músculo apresenta uma proporção específica de diferentes tipos de fibras. Tipos de fibras musculares na tabela 1.
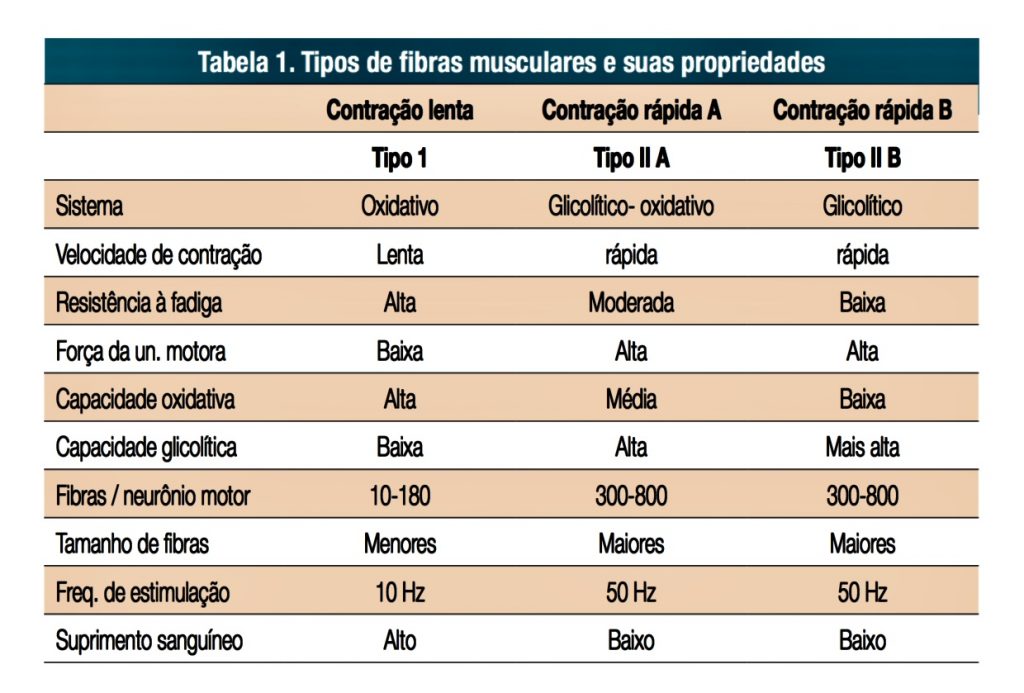
Tabela 1. Tipos de fibras musculares
A liberação dos neurotransmissores do terminal neuromotor para o espaço sináptico cria um potencial de ação na membrana da célula muscular que se estende pelas pregas da membrana celular até o retículo sarcoplasmático, que tem a função de armazenar íons de cálcio essenciais para a contração muscular. Este libera íons de cálcio para o interior do sarcoplasma e dispara a contração simultânea das miofibrilas por toda a célula.
Admite-se, que para a contração do músculo, um conjunto de filamentos (Actina) deslize por sobre um outro (Miosina), mas sem encurtamento real de nenhuma das seções de filamentos. As “pontes cruzadas” entre as seções formariam o complexo ACTOMIOSINA, que possibilita a contração.
O arranjo das fibras musculares tem importante relação com a força. Fibras paralelas ao eixo longitudinal do músculo apresentam secção transversa pequena e geram menor força.
Os músculos são vascularizados por vasos adjacentes, com a finalidade de nutrição e remoção de catabólitos. Cada fibra muscular apresenta cerca de quatro capilares nutrientes em indivíduos sedentários, chegando a até sete capilares em indivíduos treinados.
O conceito de plasticidade muscular também inclui os complexos mecanismos moleculares de atrofia e hipertrofia. O músculo esquelético representa um tecido altamente plástico. Do ponto de vista simples, o crescimento do músculo esquelético ou hipertrofia e perda muscular ou atrofia resultam de alterações complexas nas vias de sinalização intracelular no núcleo e citoplasma.
A hipertrofia muscular representa um processo intracelular secundário aos estímulos de exercícios anabólicos através do bloqueio de caminhos proteolíticos, ativação da síntese de proteína da actina e de miosina e ativação de células satélites. A hipertrofia muscular deve ser diferenciada da hiperplasia e pode ser dividida em dois tipos principais:
* Miofibrilar, em que ocorre aumento de componentes contráteis do sarcolema, representado principalmente por actina e outros componentes de filamento grosso
* Sarcoplasmáticos, em que há um aumento nos componentes não-convencionais, principalmente representados pelo retículo sarcoplasmático, glicogênio e creatina-fosfato
O sítio mais comum das lesões musculares nos adultos é a junção miotendínea e a maioria das lesões ocorre na fase de contração excêntrica. A lesão causa um desarranjo na estrutura das fibras musculares, desencadeando um processo de morte celular (necrose), inflamação, reparo e fibrose.
Um músculo lesionado sofre um processo simultâneo de regeneração e de cicatrização. A fisiopatologia da lesão muscular permanece parcialmente conhecida. As células musculares são permanentes e não apresentam capacidade proliferativa, mas existe uma reserva celular na membrana das fibras musculares capazes de proliferação e diferenciação, são as chamadas células-satélites.
Após o trauma, inicia-se a fase de inflamação/degeneração. A integridade do sarcolema da fibra muscular é rompida, desencadeando um processo de necrose celular. Microscopicamente ocorre a migração de células mononucleares, macrófagos e linfócitos capazes de secretar fatores de crescimento celular com funções específicas no processo inflamatório. As interleucinas (IL-8, IL-6, IL-1) e os fatores de necrose tumoral aumentam a permeabilidade local e aceleram a resposta inflamatória.
A resposta celular à inflamação se faz pelas células fagocitárias que migram para o tecido lesado. A exposição do colágeno tecidual desencadeia a liberação de fatores de crescimento quimiotáticos e mitogênicos no sítio da lesão (PGFs IGF-1 IGF-2 TGFβ HGF TNFα IL-6). A cascata de coagu- lação se inicia e os leucócitos fagocitam a maioria dos tecidos necróticos.
A intensidade do sangramento varia de acordo com a quantidade de fibras lesionadas, a proximidade de vasos e a gravidade da lesão. Pode manifestar-se por equimose local ou formação de hematoma, interfascicular, intramuscular ou subcutâneo. Esta fase dura aproximadamente de 2 a 4 dias após a lesão inicial.
A Fase de regeneração muscular se inicia 24 horas após a lesão e caracteriza-se pela expressão dos fatores reguladores miogênicos (Myf 5, Mio D, Sox15, Pax7, MNF, miogenina, MRF4). Alguns fatores de crescimento, tais como a IGF, regulam a proliferação e a diferenciação celular associadas à ativação de células-satélites, elementos fundamentais no processo de regeneração celular. As células-satélites são ativadas diferenciando-se em miotúbulos multinucleares dispostos ordenadamente para a regeneração musculoesquelética.
A regeneração é uma das respostas do tecido muscular lesionado durante a resposta inflamatória, mediante a ativação de células satélites. As células satélites são células progenitoras de músculo, quiescentes e auto-renováveis localizadas entre a membrana basal e as fibras musculares maduras, que se tornam prontamente ativadas por diversos estímulos e mecanismos diferentes, proliferando-se e diferenciando-se. Este passo representa o evento inicial e maior durante a regeneração do músculo estriado. Estas células permanecem quiescentes em adultos, mas com alta capacidade e sensibilidade para voltar a entrar no ciclo celular e para expressar fatores de crescimento.
As células satélites ativadas deixam sua localização típica após a ativação, proliferam e começam a expressar MyoD, Pax3 / 7 e Myf5, imitando em algum momento a expressão molecular geral vista durante o período embrionário. Os mioblastos se fundem e formam miotubos, que depois se fundem com células musculares maduras nos miócitos lesados e depois expressam a miogenina. O passo final da maturação do miotubo ocorre levando a uma maior produção e expressão de proteínas musculares específicas em formas imaturas. As principais vias regenerativas ativadas após lesão muscular em células satélites envolvem as vias NOTCH1 / 3, Wnt / β-catenina, TGF-β e IL-6.
Inicialmente há aumento da expressão de RNA mensageiro para a produção de colágeno tipo 3 em maior proporção do que o colágeno tipo 1. Há também pobre expressão de RNA mensageiro para miosina. A cicatriz formada é mais frágil e rígida do que o tecido não lesionado. Portanto, o processo de regeneração e de cicatrização tecidual tem demonstrado ser mais prolongado do que inicialmente se acreditava.
Durante a fase de cicatrização, que dura de três a seis dias, a liberação de TGF-β1 estimula fibroblastos a produzir proteínas e proteoglicanos, promovendo a formação da cicatriz e reparação do tecido lesado. A fibroplasia pode durar de quatro a seis semanas.
A fase de remodelação perdura por 15 a 60 dias e se caracteriza pela maturação do músculo regenerado, contração das fibras de colágeno e reorganização do tecido cicatricial.
Ao final de aproximadamente três semanas surge uma cicatriz firme, forte, resistente e pouco vascularizada. Alguns fatores podem interferir na evolução do processo de cura do tecido lesado, como: a extensão da lesão, o edema, a hemorragia, o suprimento vascular, o grau de separação tecidual, o espasmo muscular, a atrofia, a utilização de corticosteroides, presença de infecção, umidade, clima, tensão do oxigênio, idade e nutrição.
Extensas lesões musculares podem gerar grandes áreas de cicatriz e regeneração limitada. Alguns agentes antifibróticos têm sido pesquisados no sentido de bloquear a ação do TGF-ß1, como a decorina, o interferon-gama e o suramin.
Embora a maioria das lesões musculares recidive com mais frequência na primeira semana, há um risco significante de recidivas algumas semanas após a lesão.
Inicialmente há aumento da expressão de RNA mensageiro para a produção de colágeno tipo 3 em maior proporção do que o colágeno tipo 1. Há também pobre expressão de RNA mensageiro para miosina. A cicatriz formada é mais frágil e rígida do que o tecido não lesionado. Portanto, o processo de regeneração e de cicatrização tecidual tem demonstrado ser mais prolongado do que inicialmente se acreditava.
A plasticidade muscular representa um dos tópicos mais recentes em estudos neuromusculares moleculares e permitiu a compreensão de trocas de fibras tipo 1 em tipo 2 e vice-versa através de diferentes estímulos agudos ou crônicos, incluindo doenças crônicas, miopatias, estimulação elétrica e exercício físico.
As fibras musculares reinervadas após um estado pós-denervação assumem as propriedades metabólicas e mecânicas da nova unidade motora a partir das porções distal dos axônios sobreviventes que se aproximam. Estes mecanismos progridem em um período variável e incluem em casos de fibras tipo 2 ao tipo 1: aumento do retículo sarcoplásmico; aumento das propriedades oxidativas, proliferação do sarcolema mitocondrial e no consumo de oxigênio; estende os tempos de contração e relaxamento e reduz a atividade de transporte de ATPase de cálcio no retículo sarcoplásmico; e ocorre uma redução do diâmetro da fibra e da massa muscular e, portanto, mudanças na fibra tipo 1.
Referências
- Gundersen K. Excitation-transcription coupling in skeletal muscle: the molecular pathways of exercise. Biol Rev Camb Philos Soc. 2011;86(3):564–600.
- WuW,HuangR,WuQ,LiP,ChenJ,LiB,etal.TheroleofSix1in the genesis of muscle cell and skeletal muscle development. Int J Biol Sci. 2014;10(9):983–9.
- Norrby M, Tagerud S. Mitogen-activated protein kinase-activated protein kinase 2 (MK2) in skeletal muscle atrophy and hypertrophy. J Cell Physiol. 2010;223(1):194–201.
- Egerman MA, Glass DJ. Signaling pathways controlling skeletal muscle mass. Crit Rev Biochem Mol Biol. 2014;49(1):59–68.
- Sandri M. Signaling in muscle atrophy and hypertrophy. Physiology (Bethesda). 2008;23:160–70.
- DE REZENDE PINTO, WLADIMIR BOCCA VIEIRA ; DE SOUZA, PAULO VICTOR SGOBBI ; OLIVEIRA, ACARY SOUZA BULLE . Normal muscle structure, growth, development, and regeneration. Current Reviews in Musculoskeletal Medicine , v. 8, p. 176-181, 2015
- Best TM, Garrett WE Jr. In: DeLee and Drez. Orthopedic sports medicine. Basic science of soft tissue (muscle and tendon).Philadelphia: W. B. Saunders; 1994. p. 1-45.
- Buckwalter J. Current concepts review pharmacological treatment for soft tissue injuries. J Bone Joint Surg 1995;77-A:1902-1914.
- Carlsson BM, Faunkner JA. The regeneration of skeletal muscle fibers following injury: a review. Med Sci Sports Exerc 1983;15(3):187-196.
- Chan YS, Li Y, Foster W, Horaguchi T, Somogyi G, Fu FH et al. Antifibrotic effects of suranin in injured skeletal muscle after laceration. J Appl Physiol 2003;95:771-80.
- LaurinoCFS, LopesAD, ManoKS, CohenM, AbdallaRJ.Lesõesmúsculo-esqueléticas no atletismo. Rev Bras Ortop 2000;35: 364-8.
- Li Y, Huard J. Differentiation of muscle – derived cells into myofibroblasts in injured skeletal muscle. Am J of Pathology 2002;161:895-907.
- Sato K, Li Y,Foster W, Fukushima K, Badlani N, Adachi Net al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle Nerve 2003;28(3):365-72.
- ALLOZA, J F M; LAURINO, C F S ; BULLE, A S. Lesão Muscular no Supertreinamento. Revista Ars Cvrandi Clinica Médica, v. 6, p. 27-27, 1994.
